

EAP Publications | Virtual Library | Magazine Rack | Search | What's new
Ecological Solutions Roundtable
AGRO-BIO - 330 - 13
______________________________
La pourriture grise est une maladie causée par le champignon Botrytis cinerea. Cette maladie occasionne des dommages importants dans plusieurs cultures partout dans le monde. Elle est d'une importance économique particulièrement pour la culture de la fraise dans tout le Nord-est de l'Amérique du nord.
L'utilisation de fongicides chimiques tels qu'employés en agriculture conventionnelle n'est pas la solution idéale contre la pourriture grise et ce, pour plusieurs raisons. Premièrement, le champignon responsable de la maladie développe facilement une résistance aux fongicides chimiques. Deuxièmement, l'efficacité de plusieurs des fongicides homologués contre la pourriture grise est douteuse (Braun et Sutton, 1984). Troisièmement, les problèmes de résidus sur les fruits préoccupent un grand nombre de consommateurs.
Pour lutter efficacement contre la pourriture grise, il est d'abord nécessaire de bien comprendre le cycle de vie du champignon. Les moyens de lutte culturaux sont le recours à privilégier en production biologique.
Tout le monde est familier avec la mousse grise présente sur les fraises lorsque le Botrytis se développe. C'est la plupart du temps le seul dommage important causé par le champignon. En effet, le champignon responsable de la pourriture grise est plutôt inoffensif en ce sens qu'il n'affecte pas la croissance des plants ni ne cause de lésion qui pourrait affaiblir les plants. Il s'agit d'une maladie de vieillissement. Les tissus végétaux infectés ne montrent pas de symptômes avant qu'ils ne vieillissent, murissent ou meurt.
Lorsque les feuilles ou tout autre partie du fraisier vieillissent, le champignon déjà présent à l'état de spore, se développe en se servant des tissus morts de la plante comme nourriture. Il peut par après coloniser les autres parties saines du plant pour y laisser ses structures reproductrices. Pour infecter les fruits, par exemple, le champignon se nourrit des pétales vieillissant et morts des fleurs du fraisier.
Comme la vigueur des plants n'est pas en jeu, le seul fait qui menace la production est l'infection des fleurs qui entraîne l'infection des fruits. Une fois les pétales infectés, trois types de dommages peuvent survenir:
1. Le champignon peut entrer dans la fleur avant même que le fruit ne se développe. Il s'étend alors rapidement à la tige (pédoncule) du fruit, ce qui provoque sa désintégration. A moins d'être bien observateur et de passer son temps à regarder sous les feuilles, ce type de dommage est difficile à observer la plupart du temps. Dans une année très mouilleuse, les pertes de ce type, c'est-à-dire avant la mise à fruit, peuvent faire perdre la moitié de la récolte selon Delbridge (1977).
2. Le champignon pénètre à l'intérieur du calice (enveloppe extérieure de la fleur) et le rend sec, brun et friable. Cela peut se produire à n'importe quel moment dans le développement du fruit. Lorsque le fruit est encore vert, cela peut détruire seulement le calice ou, plus rarement, faire pourrir le fruit vert.
3. Le champignon s'étend des pétales morts à la base du calice où il devient passif mais toujours vivant. C'est ce type de dommage qui est le plus important car c'est ainsi que la pourriture grise se retrouve sur les fruits après la récolte. Les dommages occasionnés sont donc avant tout la pourriture des fruits plus rapide, comme en témoigne l'apparition d'un duvet gris sur les fruits atteints.
Botrytis cinerea est un champignon qui a plus de 200
hôtes dans le règne végétal. La figure 1 illustre le
développement du champignon aux différents stades de la
production de fraises.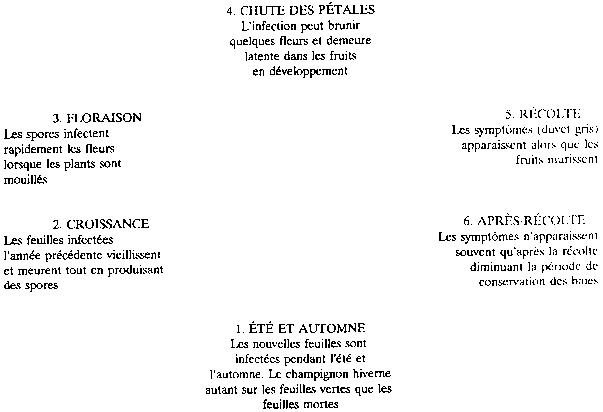
Figure 1 - Développement de Botrytis cinerea aux différents stades du fraisier
Les feuilles qui sont infectées au stade bourgeon ou à l'expansion, pendant l'automne et au printemps, sont la source de 90 à 99% d'inoculants(1) au temps de la floraison (Braun et Sutton, 1987). Les carcasses de fruits, les mauvaises herbes et la paille sont des sources très peu importantes d'inoculants, surtout au printemps.
Comme le champignon ne cause pas de lésions sur les feuilles infectées ou n'accélère pas le vieillissement des feuilles, c'est le développement des feuilles qui détermine la durée de l'infection et limite le taux d'inoculants. Les feuilles sont très susceptibles à l'infection au stade bourgeon et au début de leur développement, tandis qu'elles sont peu sensibles à leur plein développement.
Le potentiel d'infection des fleurs dépend du potentiel de formation de spores qui lui dépend de la quantité d'inoculants qu'on retrouve dans le champ au printemps. L'infection des fleurs est un prérequis à l'infection des fruits. Le développement du mycélium (la mousse grise) se fait d'abord sur les parties des fleurs les plus vieilles, soit les pétales, les sépales et les étamines. L'infection atteint éventuellement les fruits lorsqu'ils murissent, habituellement près de la tige. Cela peut détruire le fruit et servir à propager l'infection.
Comme pour la plupart des maladies fongiques, les conditions climatiques déterminent l'importance de la maladie pendant une saison donnée. Le temps de mouillure du feuillage et la température sont les facteurs à considérés. La température optimale pour le développement de l'infection tant sur les fleurs que sur les fruits est d'environ 20C et le taux d'humidité relative de 93% ou plus. Bulger et al. (1987) ont trouvé sur des fleurs inoculées artificiellement, que ces dernières étaient infectées à 100% à une température de 20C et une période de mouillure de 24 heures. L'infection était grandement réduite lorsque les températures étaient inférieures à 15C ou supérieures à 25C, et ce, peu importe la durée de la période de mouillure. Plus la période de mouillure est longue, plus grand est le nombre de fruits qui deviennent infectés.
Les fleurs affectées par la gelée sont des victimes idéales pour le Botrytis et peuvent donc servir de point de départ pour l'infection.
Le site et la méthode de plantation doivent faire en sorte d'assurer un séchage rapide du feuillage et des fleurs afin de limiter le développement du champignon. Ainsi, il faut choisir un site où l'air circule facilement, avec une bonne exposition au soleil, sur un sol qui se draine bien.
Il est préférable d'orienter les rangs dans le sens des vents prédominants, toujours pour assurer un séchage rapide du feuillage. La culture sur planche (billons) et en rangs étroits peut aussi faciliter le séchage des feuilles. Cette pratique aura ou non un effet selon les années. Ainsi, dans une fraisière en troisième année de production, Wilcox (1993) n'a pas observé de différences significatives au niveau des heures de mouillure et de l'incidence de la pourriture grise selon que les fraises étaient cultivées sur planche en rangs étroits ou à plat en rangs larges. Dans un jardin, il est préférable d'éclaircir les plants, de les garder bien dégagés pour minimiser les risques d'infection.
Le moment et les conditions climatiques lors de l'irrigation ont de l'effet sur le développement de la pourriture grise. L'idée générale encore une fois est d'éviter que le feuillage reste humide longtemps. Ainsi, le CPVQ (1985) recommande d'irriguer de préférence le jour et lorsque la température dépasse 20C. Hofstetter (1990) recommande quant à lui d'irriguer tôt le matin par journée ensoleillée de façon à accélérer le séchage de la surface du sol et donc réduire la sporulation du champignon. L'irrigation goutte-à-goutte permet de réduire les risques de maladie en gardant le feuillage sec.
La fertilisation azotée a un rôle important à jouer dans le contrôle de la pourriture grise. Ainsi, un chercheur américain a trouvé que l'incidence de la pourriture grise est accrue grandement lorsque 34 ou 67 kg/ha (30 ou 60 lbs/acre) d'un engrais azoté soluble sont appliqués au printemps (Wilcox, 1993). L'effet de la fertilisation azotée serait en fait indirect: elle provoque une croissance de feuilles abondantes, ce qui fait que l'humidité reste plus longtemps, soit 50% plus longtemps, favorisant ainsi le développement de la pourriture grise. Wilcox évalue que l'accroissement de rendement provenant de l'application printannière de l'engrais azoté ne compense pas pour les pertes encourues par l'accroissement des problèmes de pourriture grise.
Même si ce genre d'engrais très soluble n'est pas utilisé en agriculture biologique, il faut retenir qu'une fertilisation excessive en année de production favorise la pourriture grise. Dans son manuel de production biologique des petits fruits, Logsdon (1974) conseille de concentrer les applications de fertilisants dans l'année d'implantation et d'appliquer des doses très modérées ou pas du tout en année de production.
Le compost peut aussi avoir un impact sur la pourriture grise. Les composts sont riches en une foule de différents microorganismes. Il est possible de fabriquer des composts riches en trichodermes, des champignons antagonistes de Botrytis (voir plus loin, moyens de lutte biologiques). L'utilisation d'un tel compost suppressif appliqué en mulch avant ou à la floraison n'a cependant permis de réduire que de 3 ou 4% l'infection selon une recherche suédoise (Svedelius, 1989). La pulvérisation de purin de compost serait beaucoup plus efficace selon des chercheurs allemands (Stindt et Weltzien, 1988). Certains purins de compost permettent de diminuer de 50% l'infection au champ tout en augmentant les rendements. Le purin le plus efficace serait fait en laissant macérer dans l'eau un compost de fumier de cheval pendant 12 semaines (attention: ça sent fort!).
Comme mesure préventive contre la pourriture, Schmid et Henggeler (1988), sans mentionner de recherches à l'appui, conseille de fertiliser le sol avec des poudres de roches comme le basalte ou des algues calcaires, particulièrement dans les sols acides.
Une façon simple d'éviter les problèmes de pourriture grise est de faire une rotation courte, c'est-à-dire de ne faire la récolte qu'une année. Les fraisiers ne sont ainsi présents que deux années et la quantité d'inoculats n'a pas le temps de s'accroître au point de provoquer des pertes importantes. Cette méthode était fréquemment utilisée avant l'avénement des fongicides chimiques et semble maintenant adoptée par un grand nombre de producteurs de fraises biologiques ici et ailleurs. L'inconvénient majeur de la rotation courte se situe au niveau du coût d'implantation des fraisiers qui revient plus souvent. Il s'agit donc d'une méthode plus facilement envisageable pour de petites superficies que pour des grandes.
L'utilisation d'un paillis de plastique ou de paille, essentielle à plusieurs points de vue en production de fraises, permet aussi de diminuer le niveau d'inoculants et le contact des fruits et des fleurs avec le sol. Le paillis permet donc de diminuer autant la pourriture grise que d'autres types de pourriture moins fréquents mais qui s'attaquent aux fruits qui entrent en contact avec le sol. Un paillis d'aiguilles de pin est aussi envisageable dans un jardin et a l'avantage de garder le sol acide, ce qui est bon pour les fraises.
Bien qu'il se fasse de la recherche sur le sujet un peu partout dans le monde, il y a pour l'instant peu d'espoir du côté du développement de variétés de fraisiers résistants à la pourriture grise. Le risque dans tout développement de variétés résistantes, que ce soit à un insecte ou à une maladie, est que l'organisme visé s'adapte éventuellement ou que des ravageurs, autrefois peu important, viennent qu'à prendre de l'importance. Or, Botrytis cinerea est un champignon très adaptable comme en témoigne la résistance qu'il a développé à beaucoup de fongicides chimiques depuis les années '50.
Même si on ne peut considérer l'utilisation de variétés à proprement parler résistantes, on peut toutefois éviter la culture des variétés très susceptibles à la pourriture grise. En général, les variétés à fruits fermes et dont les achènes sont près de la surface sont moins susceptibles que celles à chaire molle et à graines profondes. Il y a des exceptions comme le cultivar Red Coat, qui, bien que produisant des fruits fermes, est considéré comme susceptible à la pourriture grise (CPVQ, 1985).
Au champ, la moins grande susceptibilité d'un cultivar peut en partie être attribuée au port du feuillage du fraisier. Une variété qui produit un feuillage abondant et tombant va ralentir le séchage après une pluie, et donc favoriser Botrytis.
L'une des meilleures façons d'évaluer la résistance relative de différents cultivars est de comparer leur durée de vie en entreposage. Ainsi, Daubeny et Pépin (1973), travaillant surtout avec des cultivars pour la Côte Ouest canadienne, ont constaté que les variétés Redgauntlet et Veestar se montraient moins susceptibles que d'autres après 48 heures d'entreposage. À l'université Laval de Québec, Dali et al. (1992) ont évalué quatre cultivars de l'Est canadien quant à leur durée de vie en entreposage, le principal facteur affectant cette durée étant la pourriture grise latente acquise au champ. Il est ressorti que les cultivars Grenadier et Kent se conservaient mieux que Red Coat et Bounty. Ils attribuaient ces résultats au fait qu'il s'agit de cultivars dont les fruits sont très fermes, acides et dont la respiration est faible après la récolte. Ils suggèrent que ces critères doivent être retenu lors de la sélection et le développement des cultivars de fraises en vue d'une meilleure conservation.
Le compagnonage avec l'ail serait une mesure préventive contre la pourriture grise dans toutes les cultures qui y sont susceptibles selon Schmid et Henggeler (1988). Il n'y a pas à notre connaissance d'études précises publiées sur ce sujet bien que les vertus antivirales et antifongiques des alliacées en général soit reconnues (Grainge et Ahmed, 1988).
Les fraisières infestées de mauvaises herbes qui peuvent être hôte de Botrytis sont des sources supplémentaires, quoique négligeables par rapport aux feuilles de fraisiers, d'inoculants. Plus que leur rôle mineur comme agent de transmission de la maladie, les mauvaises herbes abondantes vont faire en sorte que l'humidité restera élevée plus longtemps près des fraisiers, ce qui augmente les chances de développement du Botrytis.
Il est important de ne pas déranger le sol par le sarclage entre le moment de la floraison et la récolte de façon à ne pas répandre davantage les spores.
Notant que la récolte mécanique des fraises enlève une bonne portion des feuilles et résulte en moins de dommages par la pourriture grise l'année suivante, John Sutton de l'Université de Guelph a constaté que 90 à 95% de l'inoculant qui provoque l'infection des fleurs se retrouve sur les feuilles qui sont produites après le rajeunissement de la fraisière et sur les feuilles qui hivernent. Un des meilleurs moyens de prévenir la pourriture grise est donc de briser son cycle de vie en éliminant tout simplement les feuilles des fraisiers après la récolte. L'effet de cette technique ne se fait toutefois sentir que la saison suivante. Un autre effet positif de l'élimination du feuillage après la récolte est que les fraises, pour une raison encore mal connue, seront mûres 3 à 4 jours plus tôt le printemps suivant (Cooley, 1991).
En pratique, il y a plusieurs façons d'éliminer les feuilles, soit le brûlage, le fauchage, l'enfouissement et l'enlèvement des feuilles.
Le brûlage des feuilles est une méthode qui était employée au début du siècle pour contrôler la pourriture grise (Darrow, 1919). La méthode, qui demande beaucoup de précautions, est la suivante. On commence par faucher les plants après la récolte et laisser les feuilles sécher au champ. Les feuilles sont alors rateler au-dessus du rang avec le paillis et brûler rapidement. Si le brûlage se fait rapidement, les couronnes des plants ne seront pas endommagées. Il faut donc attendre qu'il y ait un vent léger dans la direction des rangs. Il ne faut jamais brûler quand le sol est sec ou quand le paillis et les feuilles sont trempes. Les matériaux humides brûlent lentement, ce qui peut causer une chaleur excessive qui va endommager les couronnes et les racines. En tout cas, il est prudent d'essayer d'abord sur de très petites surfaces d'abord. Il est également essentiel de respecter les règlements municipaux concernant le brûlage. Le brûlage au moyen d'une rampe thermique telles que celles utilisées pour le défanage des pommes de terre est une technique qui permet de mieux contrôler l'intensité du brûlage que le brûlage au champ.
Un inconvénient du brûlage est qu'il détruit les bons et les mauvais champignons, ce qui rend les plants très susceptibles à toute nouvelle source d'infection. Dans des essais préliminaires de brûlage, Cooley et al. (1991) de l'université du Massachusetts n'ont pas obtenu de bons résultats avec cette méthode, surtout en raison d'un mauvais désign expérimental. Le brûlage a fait accroître les problèmes de Botrytis en rendant les plants plus susceptibles aux spores en provenance des autres parcelles de l'expérience. On peut penser que la même situation pourrait se produire chez deux producteurs dont les fraisières sont voisines, l'un utilisant le brûlage, l'autre pas.
Lorsque les feuilles sont enfouies dans le sol, les spores de Botrytis ne survivent pas. Le rotocultage est donc idéal pour le rajeunissement de la fraisière et nettement plus sécuritaire que le brûlage. La charrue peut aussi être utilisée à cette fin.
Pour les très petites superficies, l'enlèvement manuel des feuilles est possible. Les feuilles recueillies peuvent être compostées ou brûlées. A plus grande échelle, outre la récolte mécanisée qui prélève une grande partie du feuillage, on pourrait également envisager l'utilisation d'un aspirateur à feuilles commercial.
Le contrôle biologique des champignons pathogènes consiste à augmenter la population d'un autre microbe qui va parasiter le champignon (hyperparasite) ou qui va prendre sa place (antagoniste) sans affecter la culture à protéger. En Europe, les essais de lutte biologique contre Botrytis cinerea ont surtout été faits avec des trichodermes. Il s'agit d'un type de champignon qui habite le sol et qui, de ce fait, n'est pas nécessairement bien adapté au feuillage et aux fleurs du fraisier. Des résultats très variables ont donc été obtenus avec les trichodermes.
Plus près de chez nous, à l'Université de Guelph, John Sutton et son équipe ont mis au point une méthode de lutte biologique qui permet de contrôler la pourriture grise aussi bien sinon mieux qu'avec un fongicide chimique comme le captan. Ils ont d'abord identifier l'agent biologique le plus efficace contre Botrytis dans nos régions. Il s'agit du champignon Gliocladium roseum, qui supprime 85% à 100% du Botrytis. De plus, contrairement à d'autres champignons antagonistes, Giocladium est efficace aussi bien à basse température (10-15C) qu'à haute température (20-25C). D'autres avantages de ce champignon sont qu'ils n'est peu ou pas détectable sur les fruits récoltés, qu'il est facile à produire et qu'il est naturellement collant. Il semble toutefois que l'efficacité de Giocladium soit moindre tard dans la saison de récolte si le temps est froid et humide (Sutton, 1994).
Le champignon Giocladium peut être appliqué de trois façons pour contrôler la pourriture grise:
1. Pulvérisé à la floraison: Cette méthode n'est pas très efficace. Le problème est que les fleurs qui ouvrent après le traitement ne sont pas protégées. Il faut donc, comme pour les fongicides chimiques, répéter les applications, ce qui résulte en un gaspillage de l'agent de contrôle biologique. Typiquement, Sutton et son équipe devaient utiliser 3 ou 4 applications par semaine de 5x106 conidies/ml pour contrôler la pourriture grise.
2. Pulvérisé au feuillage en été, au printemps et/ou en début d'automne: Cette méthode donne de très bons résultats. En pulvérisant Giocladium sur le feuillage, on prévient les dommages par Botrytis pour l'année suivante. Il est toutefois important que les feuilles soient vertes ou sénescentes, et non pas mortes, lors de la pulvérisation.
3. Dispersé par les abeilles à la floraison: Cette façon originale de répandre les spores du champignon Gliocladium permet d'amener celles-ci justement là où on les veut, soit sur les fleurs. Un mélange de spores, de talc et de farine de maïs (5x108 spores/g) est placé dans un plateau amovible disposé à la sortie de la ruche. Lorsqu'elles décollent, les abeilles ont des spores du champignon collés à leurs corps et les amènent directement aux fleurs. Un des problèmes avec ce système est que les abeilles vont souvent sur d'autres fleurs que celles des fraisiers. Il faut donc disposer les ruches de façon à ce qu'elles soient le plus loin possible d'autres sources de nectars présentes près du champ de fraise. Le nombre de colonies nécessaires est le même que pour la pollinisation.
Les spores de Gliocladium, bien qu'on les retrouve naturellement au champ, ne sont pas encore disponibles commercialement à ce jour (1994). Un des principaux obstacles à la commercialisation des pesticides biologiques comme Giocladium est leur homologation au niveau fédéral. Aux USA, les agents de contrôle biologique dispersés par les insectes n'ont pas besoin d'être homologués.
Selon Sutton (1991), les fongicides inorganiques comme le soufre, la bouillie sulfocalcique et la bouillie bordelaise, qui sont souvent employés contre les maladies en agriculture biologique, ne sont pas efficaces contre la pourriture grise bien que certains praticiens (ex.: Richard, 1987) en recommandent l'emploi. Ils engendreraient de plus des goûts désagréables aux fraises et pourraient avoir des effets indésirables sur les fraisiers.
Comme la prèle est riche en silice, et que la silice joue un rôle important dans la prévention des maladies, les décoctions de prèle sont souvent recommandées en agriculture biologique en prévention contre les maladies. Schmid et Henggeler (1988) recommande d'arroser le sol et les plantes au printemps et en automne avec une décoction de prêle concentrée en ajoutant même 0,5 à 1,0% de silicate de soude à la décoction.
DÉCOCTION DE PRÈLEMettre à tremper pendant 24 heures 1 kg de prèle fraîche (parties aériennes) ou 150g de prèle séchée dans 10 litres d'eau. Faire bouillir pendant vingt minutes, couvrir et laisser refroidir. Dilué 5 fois avant d'appliquer au feuillage. |
Il y a maintenant une méthode de lutte contre la pourriture grise dans la fraise qui utilise les fraises elles-mêmes! Aux USA, des chercheurs du Département américain de l'agriculture en Illinois ont breveté un concentré d'arôme de fraise qui lorsqu'appliqué aux fraisiers permet de contrôler la pourriture grise. Un des composés aromatiques de la fraise, le 2-nonanone, à concentration de 400 ppm a permis d'inhiber la croissance non seulement de Botrytis mais aussi de deux autres champignons qui s'attaquent aux fraises (Alternaria alternata, Coleotrichum gloeosporioides). Le composé en question ne se dégrade pas vite et serait très économique à l'usage. Une formulation commerciale devrait être disponible dans les années à venir.
Dans le même ordre d'idée, à l'université Laval à Québec, Ghaouth et al. (1993) ont utilisé des extraits d'achènes (les petites graines en surface des fruits) de fraise avec succès pour limiter le développement du champignon.
L'utilisation du bicarbonate de sodium comme fongicide a commencé au Japon dans les années '70, et s'est avéré très efficace contre plusieurs maladies. Sur fraisier, des chercheurs japonais ont démontré l'efficacité d'une application hebdomadaire de bicarbonate contre le blanc, autant en prévention qu'après l'apparition des symptômes. En Angleterre, où les cahiers de charge biologique accepte le bicarbonate de sodium comme fongicide, Harris et al. (1990) ont démontré qu'une solution de bicarbonate et de savon doux réduisait de façon significative le développement de la moisissure grise de la févérole (Botrytis fabae) et retardait l'apparition des symptômes sur les feuilles. Il n'y a pas à notre connaissance de recherches publiées sur l'utilisation du bicarbonate contre la moisissure grise de la fraise (Botrytis cinerea), mais il serait surement intéressant d'en faire l'essai sur une petite superficie, en se rappelant toutefois qu'il s'agit d'un produit qui n'est pas homologué pour cet usage au Canada.
FONGICIDE À BASE DE BICARBONATE DE SOUDEMélanger simplement: - 10 grammes (1 c. à table) de bicarbonate de soude - 4 litres d'eau - 40 ml (2½ c. à table) d'huile horticole ou de savon doux |
D'après des recherches non-publiées de Sutton cité par Hofstetter (1990), une simple solution faite d'eau et de sucre blanc appliquée deux fois pendant la floraison peut réduire de 50% ou plus la pourriture grise. Dan Tawczynski, un producteur de fraises du Massachusetts a utilisé cette méthode avec de très bons résultats même dans une année mouilleuse. Il a dissous 0,6 kg de sucre blanc dans 100 litres d'eau (5 livres dans 100 gallons) et a appliqué ce mélange deux fois, soit au début de la floraison et en fin de floraison. Il a obtenu moins de 4% d'infection sur un champ d'un peu plus d'un hectare selon les chercheurs qui sont venus mesurés le taux d'infection sur sa ferme. On peut supposer que le sucre a encouragé certains microorganismes antagonistes comme Giocladium au détriment de Botrytis.
L'acide propionique, un composé chimique odorant et relativement doux (rapidement biodégradable) utilisé en médecine comme fongicide topique, est modérément efficace contre le champignon. Appliqué au feuillage à l'automne et tôt au printemps en solution de 5% v/v (5 litres d'acide dans 100 litres d'eau), il diminue le nombre de fruits affectés par la pourriture grise la saison suivante (Sutton, 1991). L'acide propionique n'est pas accepté par les cahiers de charge d'agriculture biologique.
Il va de soi qu'il faut être sélectif lors de la récolte. Le moment de la journée pour la cueillette aurait une importance sur l'apparition de la pourriture grise par la suite selon le National Research Council des États-Unis (NRC, 1968), sans spécifier quel est le meilleur temps. On peut supposer que les risques de contamination sont moins grands lorsque les fruits sont secs, bien que la température ait aussi beaucoup d'importance sur le développement du champignon.
Une fois les fruits cueillis, il est encore possible de diminuer le développement de la pourriture grise. Maas (1980) a fait la revue de toutes les techniques possibles à l'entreposage. Au mieux, il juge que les techniques utilisées à l'entreposage ne permettent que de retarder le développement de la pourriture grise.
Le traitement par la réfrigération ou le prérefroidissement entre 0 et 4C ralentit le développement du Botrytis mais ne l'arrête pas complètement car le champignon peut se développer même à 0C. Aussi, l'humidité relative doit être gardée à environ 90% pour limiter l'infection. Le prérefroidissement serait essentiel lorsqu'on considère conserver des fraises pendant plus d'une journée (Lépine, 1988). Pour plus de détails sur les techniques de prérefroidissement, consulter les ingénieurs des bureaux régionaux du MAPAQ.
Un exposition des fraises à de l'air chaud et humide permet aussi de réduire d'environ 50% les pertes après récolte selon Maas (1980). La meilleure combinaison serait une exposition des fruits a de l'air à 44C, 90% d'humidité relative pendant 40 minutes.
En entreposage à atmosphère contrôlée, les fraises se conservent le mieux à une concentration de CO2 élevée. La concentration optimum pour empêcher le développement de la pourriture grise est de plus de 20% de gaz carbonique avec une température de 3 à 5C. Il ne faut pas dépasser 30% de gaz carbonique car les fraises développent alors un mauvais goût persistant. Les pertes dues à Botrytis peuvent être réduites en diminuant la concentration d'oxygène à 1,5% ou moins mais, en pratique commerciale, seulement le gaz carbonique est ajusté. En pratique, après 7 jours en entreposage à atmosphère contrôlée, les fraises même si elles sont encore belles, perdent du goût. Le transport des fraises en atmosphère contrôlée permet de rallonger de deux jours leur conservation.
La combinaison de plusieurs techniques permet de réduire davantage les pertes dûes à la pourriture grise que l'utilisation d'une seule technique. Au Québec, Lépine (1988) a pu préserver des fraises cueillies à maturité de la variété Red Coat pendant 10 jours en combinant le prérefroidissement et l'entreposage à 5C dans une atmosphère contrôlée composée de 16% de CO2, 20% d'oxygène et 64% d'azote. Lépine évalue que pour rentabiliser prérefroidissement et atmosphère contrôlée, un producteur doit produire au moins 5 hectares de fraises. Cette combinaison ne semble donc pas envisageable pour l'instant pour la grande majorité des producteurs bio qui produisent surtout sur de petites superficies.
Pour le transport, une façon pratique et relativement peu coûteuse d'obtenir à la fois refroidissement et augmentation du gaz carbonique est d'utiliser de la glace sèche, qui est en fait du gaz carbonique solidifié.
* La pourriture grise est une maladie qui fait plus de dommages en année mouilleuse. Les conditions optimums de développement du champignon sont une humidité relative de plus de 93% pendant 24 heures et plus à 20C.
* Les feuilles du fraisier infectées l'année précédente ou au printemps sont la principale source d'inoculants pour l'infection des fleurs. Les feuilles en développement sont les plus susceptibles à l'infection.
* Les pratiques culturales qui favorisent le séchage rapide des feuilles réduisent de beaucoup le développement du champignon: plantation sur site bien aéré et ensoleillé; sol bien drainé; plantation sur planche en rangs étroits; irrigation par temps ensoleillé; fertilisation prudente en année de production.
* Les variétés qui produisent des fruits fermes et acides résistent mieux à la pourriture, surtout en entreposage.
* Le niveau d'inoculants peut être réduit par: une rotation courte; la présence d'un paillis; le brûlage, l'enfouissement ou l'enlèvement des feuilles.
* Pour le contrôle biologique, le champignon Giocladium roseum, appliqué au feuillage à l'automne ou distribué par les abeilles à la floraison, est très efficace mais n'est pas disponible commercialement pour le moment (1994).
* L'application de soufre ou de cuivre n'est pas recommandée contre la pourriture grise. Une solution sucrée appliquée deux fois à la floraison réduit les dommages. Des substances chimiques qui peuvent être employées contre la maladie et qui sont douces pour l'environnement sont le bicarbonate de soude et l'acide propionique. Un produit efficace à base d'arôme de fraise devrait être disponible dans les années à venir.
* La réfrigération et l'entreposage à atmosphère contrôlée retarde le développement de la pourriture grise. La glace sèche peut être utilisée lors du transport.
Braun, P.G. et J.C. Sutton. 1984. Effectiveness of fungicides in reducing inoculum production by Botrytis cinerea in dead strawberry leaves. In Proceedings of the British Crop Protection Conf. Pest. Dis., vol. 3:971-976.
Braun, P.G. et J.C. Sutton. 1987. Inoculum sources of Botrytis cinerea in fruit rot of strawberries in Ontario. Revue canadienne de phytopathologie, 9:1-5.
Bulger, M.A., M.A. Ellis et L.V. Madden. 1987. Influence of temperature and wetness duration on infection of strawberry flowers by Botrytis cinerea and disease incidence of fruit originating from infected flowers. Phytopathology, 77:1225-1230.
Cooley, D, D. Marchant et S. Schloemann. 1991. Alternative chemical and cultural management of Botrytis grey mold in strawberry. Northeast LISA Small Fruit Newsletter, 2(2):10-11.
CPVQ (Conseil des Productions Végétales du Québec). 1985. Petits fruits. Culture. Agdex 230/20. Ministère de l'agriculture, des pêcheries et de l'alimentation du Québec, Québec. 35 pages.
Dali, N., C. Willemot, J. Maklouf, J. Arul, A. Gosselin et Y. Desjardins. 1992. Comparison of storage potential of four Canadian strawberry cultivars. Advances in Strawberry Research, 11:17-20.
Damsker, M. 1994. Berries beat mold - naturally. Organic Gardening, janvier 1994:20.
Darrow, G.M. 1919. Strawberry culture: Eastern United States. United States Department of Agriculture. Farmer's Bulletin #1028. 50 pages.
Delbridge, R.W. 1977. Strawberry diseases. Prince Edward Island Dept. of Agriculture and Forestry, Charlottetown, PEI.
El Ghaouth, A., J. Arul, J. Grenier et A. Asselin. 1991. Glucanohydrolases and inhibitory activity to Botrytis cinerea in extracts from strawberry fruits. Revue canadienne de phytopathologie, 13:315-320.
Galletta, G.J. 1980. Breeding strawberries for disease resistance. pages 193 à 205. In Childers, N.F. The strawberry: varieties, culture, pests and control, storage, marketing. Proceedings of the National Strawberry Conference, St-Louis, Missouri, 1980. Horticultural Publications, Gainesville, Floride.
Grainge, M. et S. Ahmed. 1988. Handbook of Plants with Pest-Control Properties. John Wiley & Sons. New York.
Harris, P.J.C., W.F. Bourne et M. Lennartsson. 1991. The use of sodium bicarbonate as a fungicide. Compte-rendu de la 8ème conférence internationale de l'IFOAM (International Federation of Organic Agriculture Movements), Budapest, Hongrie.
Hofstetter, B. 1990. Nature's fungicides may banish Botrytis. New Farm, mai-juin 1990:31-32,41.
Lépine, Y. 1988. Strawberry handling in Quebec. Thèse de maîtrise, Département de génie rural, Campus Macdonald, Université McGill.
Maas, J.L. 1980. Postharvest diseases of strawberry. pages 329 à 353 In Childers, N.F. The strawberry: varieties, culture, pests and control, storage, marketing. Proceedings of the National Strawberry Conference, St-Louis, Missouri, 1980. Horticultural Publications, Gainesville, Floride.
Marchant, D., D. Cooley et S. Schloeman. 1991. Grey mold in strawberries: where we're headed in terms of management. Northeast LISA Small Fruit Newsletter, 2(1):8-9.
Maude, R.B. 1980. Disease control. pages 275-308 In Coley-Smith et al.. 1980. The biology of Botrytis. Academic Press, Londres.
NRC. 1968. Plant-disease development and control. Principles of plant and animal pest control. Vol. 1. National Academy of Sciences, Washington.
Peng, G., J.C. Sutton et P.G. Kevan. 1992. Effectiveness of honey bees for applying the biocontrol agent Gliocadium roseum to strawberry flowers to suppress Botrytis cinerea. Revue canadienne de phytopathologie, 14:117-129.
Peng, G. et J.C. Sutton. 1991. Evaluation of microorganisms for biocontrol of Botrytis cinerea in strawberry. Revue canadienne de phytopathologie, 13:247-257.
Richard, J. 1987. Fruits et petits fruits. Production écologique. Éditions Marcel Broquet, Ottawa. 337 pages.
Schmid, O. et S. Henggeler. 1988. Ravageurs et maladies au jardin. Terre Vivante, Paris. 243 pages.
Stindt, A. et H.C. Weltzien. 1988. [Use of compost extract for the control of Botrytis cinerea on strawberries - results of experimental year 1987]. Gesunde Pflanzen, 40(11):452-454.
Sutton, J.C. 1994. Biological control of strawberry diseases. Advances in Strawberry Research, 13:1-12.
Sutton, J.C. et G. Peng. 1993a. Manipulation and vectoring of biocontrol organisms to manage foliage and fruit diseases in cropping systems. Annual Review of Phytopathology, 31:473-493.
Sutton, J.C et G. Peng. 1993b. Biocontrol of Botrytis cinerea in strawberry leaves. Phytopathology, 83:615-621.
Sutton, J.C. 1991a. Biological control of Botrytis grey mold in strawberry. Northeast LISA Small Fruit Newsletter, 2(2):1-3.
Sutton, J.C. 1991b. Alternative methods for managing grey mold of strawberry. In Dale, A. et J.J. Luby (eds). The strawberry into the 21st century. Proceedings of the 3rd North American Strawberry Conference, Houston, Texas. Timber Press.
Sutton, J.C., T.D.W. James et A. Dale. 1988. Harvesting and bedding practices in relation to grey mould of strawberries. Annals of Applied Biology, 113:167-175.
Svedelius, C. 1989. [Studies on the effect of a mulching compost (Biobalans) rich in Trichoderma spp. on the incidence of grey mould, Botrytis cinerea, in strawberries]. Växtskyddsnotiser, 53(1-2):30-37.
Wilcox, W.F. 1993. Control of gray mold of strawberry through cultural manipulations of fruiting-zone microclimate. Reports pertinent to the IPM effort at Cornell University, New York State IPM Publication #208: 83-85.
1. Le champignon hiverne sous forme de sclérotes et de mycélium, des structures de reproduction auxquelles on réfère ici sous le nom d'inoculants.
MISE-EN-GARDE Ce document a pour but de faire la synthèse de l'information scientifique et populaire disponible sur le sujet traité, dans une perspective d'agriculture biologique. Il ne s'agit donc pas de recommandations ou d'un guide de production. |
© Reproduction interdite sans autorisation
Copyright © 1994 Projet pour une agriculture écologique. Tous droits réservés.
Info Request | Services | Become EAP Member | Site Map
Give us your comments about the EAP site
Ecological Agriculture Projects, McGill University (Macdonald
Campus)
Ste-Anne-de-Bellevue, QC, H9X 3V9 Canada
Telephone:
(514)-398-7771
Fax:
(514)-398-7621
Email: info@eap.mcgill.ca
To report problems or otherwise comment on the structure of this site, send mail to the Webmaster